CO 산화
CO는 연소시, CO2를 배출할 수 있는 물질이 불완전 연소될 때 생성된다. 고도로 산업화된 현재, 내연기관에서 발생하는 CO의 양을 줄일 필요가 있다. 단순히 CO를 고온에서 완전산화 시킴으로써 양을 줄일 수도 있지만, 이는 에너지적 손실이 크고, 다른 대기오염 물질을 발생시킬 수 있기 때문에 다른 방법 중 하나인 촉매를 이용하는 방법으로 CO를 CO2로 산화 시켜 화학적 제거를 하기로 했다. CO의 산화는 다음의 반응을 따른다.
CO + (1/2)O2 → CO2, ᐃH° = -283 kJ/mol
식1. CO의 산화 반응식, 반응열
촉매의 종류
실험에 사용된 촉매는 백금 촉매(3wt%Pt-4.5wt%Sn)이다. 백금은 산화 반응 외에도 대부분의 반응에 좋은 활성을 보여주어 촉매로서 사용되기 좋은 금속이지만, 금보다 희귀하며 가격이 비싸기 때문에 경제적인 측면에서 촉매로 쓰이기에는 부적합하다. 따라서 대체할 수 있는 촉매의 제조가 필요하고, 구리와 망간을 이용해 백금보다 경제적인 촉매를 만들 수 있다
촉매 제조법
촉매의 대표적인 제조법으로는 침전법 중, 공침법이 있다. 공침법은 침전법의 일종으로써 2개 이상의 금속이온을 용액에서 동시에 침전시키는 방법을 말한다. 예를들어 구리-망간 촉매 제조법의 경우, 아세트산구리(II) 수용액과 아세트산망간(II) 수용액을 잘 녹여서 혼합한 후, 탄산나트륨 수용액을 조금씩 넣어 침전물을 생성시킨다. 이후 여과기에 침전물을 여과하고, 건조한 후, 소성하는 방법으로 촉매를 제조한다. 이렇듯 더 경제적인 촉매를 만들 수 있지만 이번 실험에서는 따로 촉매 제조는 하지 않았고, 백금 촉매를 그대로 쓰며 실험을 진행했다.

분석장비(GC)
이번 실험에서 쓰이는 분석장비는 GC(Gas Chromatography)이고, 검출기로는 TCD(Thermal Conductivity Detector), 범용적인 검출기를 사용했다. TCD는 이동상 기체의 열전도도와 다른 열전도도를 갖는 화합물을 감지하는데 근거를 둔다.
GC를 이용하기 위해선 GC의 전원을 킨 후, 칼럼안에 남아있던 가스를 빼기 위한 안정화를 필요로 한다. 반응기에는 촉매를 장착할 수 있고, 온도 컨트롤러를 통해 반응온도와 반응시간을 설정할 수 있으며, 흘려줄 물질의 유량도 설정할 수 있다. 반응기와 GC는 Six-Way밸브가 연결해주며 Six-Way밸브는 샘플물질이 들어오고 나가는 라인 2개, 운반기체가 들어오고 나가는 라인 2개, 그리고 샘플물질을 Load하고 Injection하기 위한 포집라인 2개로 구성되어 있다.

실험방법
1. GC를 키고, 칼럼안에 남아있는 가스를 제거하기 위해 안정화 시킨다.
2. 3wt%Pt-4.5wt%Sn 촉매를 0.3g 반응기에 넣고 반응기를 장착한다.
3. 온도 컨트롤러를 300℃, 130분으로 맞춘다.
4. 실험 진행 전, CO와 Air의 유량을 각각 측정한다. (이때 BFM을 이용하고, Bubble의 시간당 진행된 면적을 통해 유량을 직접 측정할 수 있지만, 이 실험에서는 CO의 유량을 10mL/min, Air의 유량을 20mL/min로 설정하기 때문에 실제 유량 값과는 다르게 진행된다.)
5. CO와 Air를 흘려주며 실험을 시작한다.
6. 실험 시작 5분 후부터 샘플링을 시작하고, 25분 간격으로 총 6회 샘플링을 진행한다. (샘플링시 Load로 약 30초간 대기 후, Inject하며 진행하고, 샘플링 후 다음 샘플링까지 25분 간격을 유지하는 이유는 안정화를 하기 위함이다.)
7. 피크가 나오면 값을 보정 후 저장하고, 전환율을 계산한다.
실험결과
실험방법에 따라 CO 산화 반응 실험 데이터를 총 6회 측정 및 분석했다. 그 중 첫번째 샘플링 결과는 아래 표1과 같다. 첫번째 샘플링 결과에 CO피크가 찍히지 않았기 때문에 첫번째 샘플링 결과는 실험결과 및 분석에서 제외한다.
| Peak | RT | Area | Area % | Gas |
| 1 | 1.23 | 395840.9 | 31.523 | N2, O2 |
| 2 | 3.73 | 756619 | 60.254 | - |
| 3 | 5.87 | 103251.6 | 8.223 | Ghost |
표 1. 첫번째 샘플링(5m-50℃)
샘플링 횟수별 CO의 전환율을 계산할 때, 첫번째 크로마토그램의 CO피크 면적을 A, 각 크로마토그램의 CO 피크 면적을 B라고 한다면 전환율을 구하는 공식은 다음과 같고, 위에서 언급한대로 이번 실험에서 첫번째 샘플링의 결과에는 CO피크가 찍히지 않았기 때문에 두번째 샘플링의 CO피크 면적을 A로 계산한다.
전환율 = (A-B)/A × 100
식 2. 전환율 공식
다음은 각 샘플링 결과 별, CO의 전환율을 구한 것이다.
| peak | RT | Area | Area % | Gas |
| 1 | 1.23 | 762678.6 | 40.564 | N2, O2 |
| 2 | 1.563 | 24707.6 | 1.314 | CO |
| 3 | 3.95 | 1037450.9 | 55.179 | - |
| 4 | 5.944 | 55335 | 2.943 | Ghost |
표 2. 두번째 샘플링(30m-85℃)
| Peak | RT | Area | Area % | Gas |
| 1 | 1.161 | 691531.4 | 36.139 | N2, O2 |
| 2 | 1.488 | 19130.3 | 1.000 | CO |
| 3 | 4.063 | 1170482.7 | 61.170 | - |
| 4 | 6.09 | 32362.4 | 1.691 | Ghost |
표 3. 세번째 샘플링(55m-142℃)
| Peak | RT | Area | Area % | Gas |
| 1 | 1.19 | 810746.5 | 38.707 | N2, O2 |
| 2 | 1.526 | 23295.5 | 1.112 | CO |
| 3 | 4.13 | 1185392.4 | 56.593 | - |
| 4 | 6.115 | 75165.2 | 3.589 | Ghost |
표 4. 네번째 샘플링(80m-194℃)
| Peak | RT | Area | Area % | Gas |
| 1 | 1.23 | 618102.4 | 91.662 | N2, O2 |
| 2 | 1.561 | 6942 | 1.029 | CO |
| 3 | 4.97 | 5084.6 | 0.754 | CO2 |
| 4 | 6.207 | 44201.3 | 6.555 | Ghost |
표 5. 다섯번째 샘플링(105m-248℃)
| Peak | RT | Area | Area % | Gas |
| 1 | 1.232 | 835127.8 | 96.176 | N2, O2 |
| 2 | 1.558 | 3662 | 0.422 | CO |
| 3 | 4.963 | 4826.1 | 0.556 | CO2 |
| 4 | 6.21 | 24716.2 | 2.846 | Ghost |
표 6. 여섯번째 샘플링(130m-300℃)
각 샘플링 횟수별 결과에 따른 CO의 전환율을 정리한 그래프는 아래 그래프1과 같다. 반응온도와 반응시간이 증가함에 따라 전환율이 상승하는 모습을 확인할 수 있다.

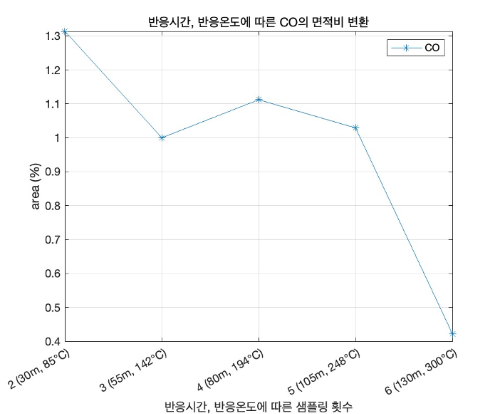
2~6번째 샘플링 결과를 RT값에 따른 면적값으로 나타낸 표는 아래 표7과 같고, 표7을 기반하여 CO와 CO2의 샘플링 횟수별 면적 변화를 그래프로 나타낸 것은 아래 그래프2와 같다.
| RT(min) | 2.(30m-85℃) | 3.(55m-142℃) | 4.(80m-194℃) | 5.(105m-248℃) | 6.(130m-300℃) |
| 1.2(N2,O2) | 762678.6 | 691531.4 | 810746.5 | 618102.4 | 835127.8 |
| 1.5(CO) | 24707.6 | 19130.3 | 23295.5 | 6942 | 3662 |
| 4.9(CO2) | --- | --- | --- | 5084.6 | 4826.1 |
| 6(Ghost) | 55335 | 32362.4 | 75165.2 | 44201.3 | 24716.2 |
표 7. RT값에 따른 물질의 area값

고찰
표7과 그래프2를 보면 샘플링 횟수에 따른 각 RT값의 면적 값을 확인할 수 있다. 1.2RT는 질소와 산소의 피크를 뜻하고, 1.5RT는 CO의 피크를 뜻한다. 4.9RT는 CO2의 피크를 뜻하는데 네번째 샘플링까진 CO2 피크가 안 찍혔지만, 다섯번째 샘플링부터 CO2 피크가 찍히며 면적이 늘어나고, CO의 면적은 크게 줄어드는 것을 확인할 수 있다. 6RT는 Ghost 피크로 불순물을 의미한다.
표1에서부터 표4까지를 보면 3.7~4.1RT값에서 피크가 찍히는 것을 확인할 수 있다. 이는 CO가 CO2로 산화된 것이 아닌, 다른 불순물에 의해 찍힌 피크이거나 혹은 다양한 요인들에 의해 찍힌 피크로 해석된다.
첫번째 샘플링의 결과인 표1에서부터 3.7RT값에 찍힌 피크의 면적비는 60%로 Air와 Ghost피크의 면적비를 합친 값보다도 큰 값을 보여준다. 네번째 샘플링까지 RT값은 4.1까지 증가하면서도 면적비가 50%밑으로 낮아지지 않으며 유지가 된다. 이를 확인했을 때, 유량으로 흘려 넣은 Air와 CO외의 물질이 피크로 찍힌 것과 같은 결과로 이전 실험에 사용된 물질들이 잔류 되어 있는 듯한 생각이 들었고, 실험을 시작하기전 TCD의 안정화 과정이 제대로 진행된 것이 맞는지에 대한 의문이 들었다. 안정화 과정의 진행이 제대로 끝나지 않아 칼럼에 잔류 되어 있는 gas는 CO의 산화 반응을 방해하며 피크에 영향을 끼칠 수 있기 때문이다.
샘플링 횟수에 따른 CO의 전환율을 나타낸 그래프1을 보면, 다섯번째 샘플링 결과, 71.9%의 전환율을 보이고, 여섯번째 샘플링 결과에서는 85.2%의 전환율을 보인다. 이는 전환율이 전보다 13.3%p 상승한 수치이다. 그럼에도 불구하고 CO2의 면적은 오히려 감소하는 결과를 확인할 수 있는데 이는 CO의 산화 반응이 제대로 진행되지 않았거나, CO의 다른 반응이 일어났다고 볼 수 있는 결과라고 생각한다.
실험결과만 생각해본다면, 다섯번째 샘플링 결과부터 CO의 전환율이 급격히 높아지며 CO2의 피크가 찍히기 시작하기 때문에, 백금 촉매를 이용한 CO의 산화 반응은 반응온도가 약 248℃에서부터 활발히 진행되는 것인가 싶은 생각이 들었다. 하지만 백금 촉매를 이용한 CO의 산화 반응 논문을 살펴보면 반응온도 60℃에서부터도 유의미한 전환율을 보여주기 때문에 이번 실험에서 CO의 전환율이 뒤늦게 높아지는 결과는 다른 요인들에 의한 오차일 것 같다는 생각이다
결론
촉매를 이용한 CO 산화 반응은 산업에서 CO를 정화하는 효과적인 방법으로 적합하다. 상대적으로 낮은 온도와 적은 시간으로 CO를 산화시켜 제거하는 것은 환경적인 면과 에너지 손실을 생각했을 때, 고온에서 완전산화 시키는 것보다 좋기 때문이다.
이번 실험을 통해 백금 촉매에 따른 CO의 산화 반응을 진행함으로써 반응온도와 반응시간에 따른 CO의 전환율과 면적의 변화를 확인할 수 있었다. 실험결과, 초기온도에서 CO의 피크가 찍히지 않았지만, 두번째 샘플링부터 CO의 피크가 찍혔고, CO 면적의 변화는 계속해서 일어났지만 CO가 CO2로 전환되기 시작한 것은 다섯번째 샘플링부터였다. 전환율 또한 앞서 조금씩 상승하던 것과 다르게 다섯번째 샘플링부터 급격하게 상승한다.
CO의 면적과 면적비 그래프의 개형을 살펴보면 다른 모습인 것을 확인할 수 있고, 이를 CO2의 면적 변화와 비교해보면 CO가 CO2로 전환되는 비율은 크지 않다는 것을 알 수 있었다. 따라서 이번 실험에서 CO는 예상된 CO2로의 산화반응 외 추가적인 다른 반응을 한 것 같은 모습을 보이거나 불순물에 의한 오차가 확인되며, 이번 실험의 결과만 봤을 때, CO 산화 반응에 백금 촉매가 효과적으로 작용하는지는 의문이다. 따라서 똑같은 실험방법으로 다시 한번 직접 실험을 진행해보고, 이번 실험과 비슷한 결과가 나오는지 혹은 더 높은 전환율 및 더 낮은 온도에서부터 CO2 피크가 찍히는지 확인하고 싶은 생각이다.
참고문헌
(1) 이학범, 고형림 저, “구리복합산화물 촉매상에서 일산화탄소의 산화반응”, 한경대학교, 화학공학과, 130p, 2016. 03. 22.
(2) 김영철, 김재승 외 3명 저, “백금과 세리아를 담지한 촉매의 포름알데히드 산화반응에 관한 연구”, 전남대학교, 물질화학공학과, 57p~58p, 1996.
(3) 성준용, 강기운 외 3명 저, “자동차 관리상의 문제점과 대기오염 감소화전략 : 자동차 배기가스에 의한 서울시의 대기오염 실태를 중심으로”, 광운대학교, 행정학과, 73p~76p, 1998.
(4) 박정현, 조경호 외 2명 저, “서로 다른 몰비의 Al/(Al+Ce)를 가진 Al-Ce 혼합산화물에 담지된 Pt 촉매 상에서의 일산화탄소 산화반응”, 충북대학교, 화학공학과, 168p~169p, 2011.
'실험' 카테고리의 다른 글
| 기체 확산 계수 측정 실험 결과 보고서 (1) | 2024.11.26 |
|---|---|
| 프로판 탈 수소 반응 실험 결과 보고서 (0) | 2024.11.08 |
| 촉매특성분석 실험 결과 보고서 (0) | 2024.11.07 |
| PS 중합 실험, 화학반응실험 결과 보고서 (0) | 2024.02.17 |
| UV-VIS, 흡광광도법 인산전량 정 분석 실험 결과 보고서 (0) | 2024.01.22 |




댓글